简介
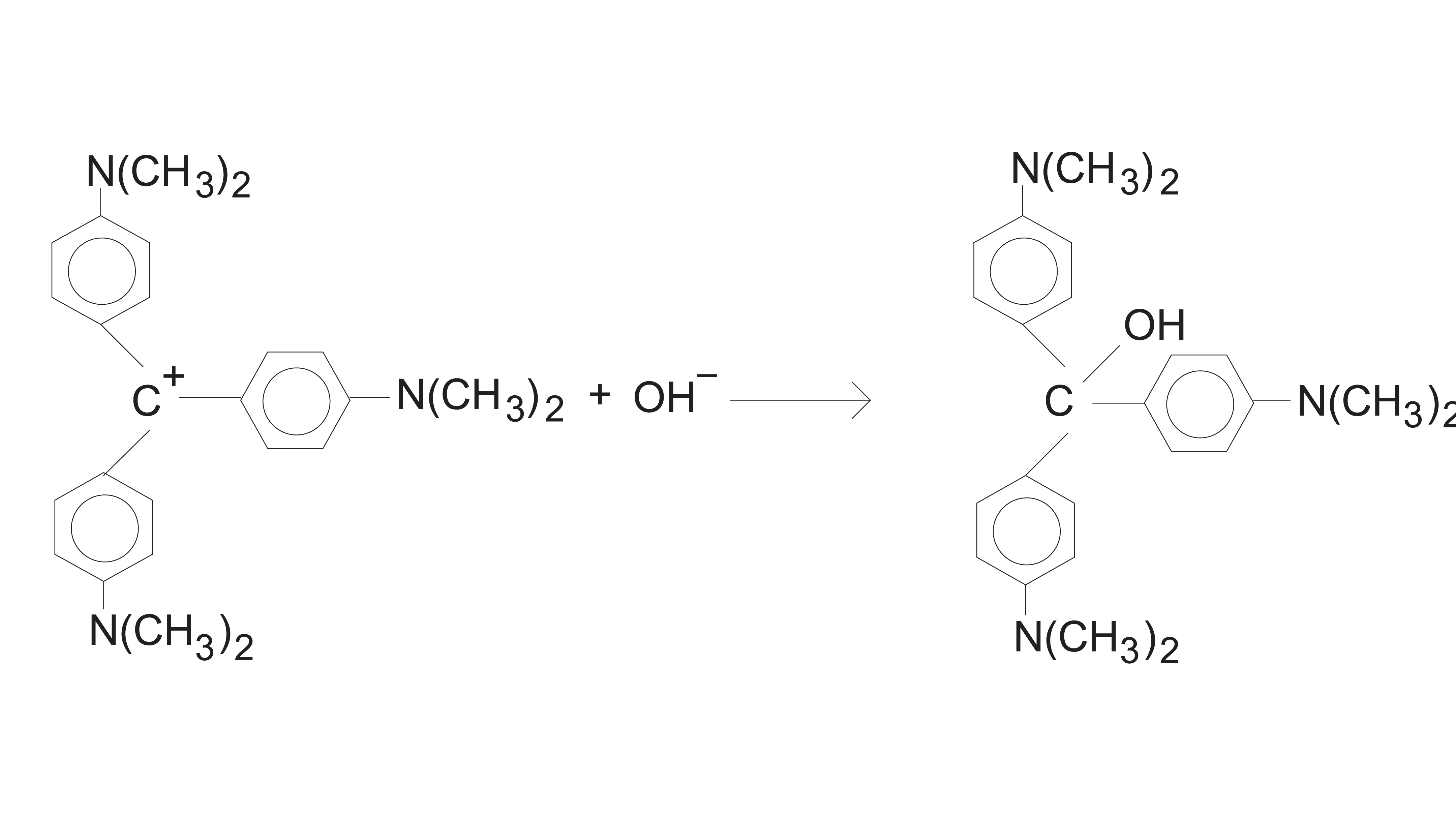
在这个实验中,你将观察结晶紫和氢氧化钠之间的反应。目的之一是研究结晶紫浓度与反应时间的关系。这个方程的简化版本是:
这个反应的速率定律是:速率=k(简历+]米[哦- - - - - -]n,在那里k是反应的速率常数,米水晶紫(CV+),n是关于氢氧根离子的顺序。因为氢氧根离子的浓度是结晶紫浓度的1000倍以上,[OH- - - - - -]在实验过程中不会发生明显变化。因此,你会发现水晶紫的顺序(米),而不是氢氧根的顺序(n).
随着反应的进行,紫色的反应物会慢慢变成无色的产物。你可以用游标色度计或游标光谱仪测量颜色变化。当然,本实验中使用的结晶紫溶液是紫色的,因此色度计用户将被指示使用565 nm(绿色)LED。光谱仪用户将根据溶液的吸收光谱确定适当的波长。我们假设吸光度与结晶紫的浓度成正比(比尔定律)。在绘制以下三张图时,将使用吸光度代替浓度:
- 吸光度vs。时间:线性图表示A零阶反应(k = -slope)
- ln吸光度vs。时间:线性图表示A一阶反应(k = -slope)
- 1 /吸光度vs。时间:线性图表示A二阶反应(k =斜率)。
一旦确定了结晶紫的顺序,你也会得到速率常数,k,以及反应的半衰期。
目标
在这个实验中,你会的
- 观察结晶紫与氢氧化钠的反应。
- 监测结晶紫溶液随时间的吸光度。
- 图吸光度vs.时间,ln吸光度vs.时间,1/Absorbancevs.时间。
- 确定反应的顺序。
- 确定速率常数,k,以及反应的半衰期。